Análisis en el neurodesarrollo y las funciones visuales en el prematuro

Resumen
Objetivo: Identificar los diferentes riesgos para las funciones visuales y del neurodesarrollo en los lactantes prematuros que permitan establecer una detección y tratamiento oportunos.
Método: Se realizó un estudio transversal en recién nacidos prematuros para analizar el efecto sobre las funciones neurovisuales relacionadas con factores de riesgo, incluyendo displasia broncopulmonar (DB), sepsis, hemorragia ventricular (HV), retinopatía del prematuro (ROP), y el efecto sobre atención, defectos oculomotores, parálisis cerebral infantil (PCI) y discapacidad visual cortical (DVC). Se utilizó la prueba exacta de Fisher.
Resultados: 113 niños (53 hombres, 60 mujeres). Edad gestacional: 30,8 +/- 3 semanas de gestación. Peso: 1586 +/- 660 g. El estrabismo estuvo en el 74%, el nistagmo en el 18,5%, DVC en el 14%. Tanto el bajo peso (0,004) como la edad gestacional (0,0001) se relacionaron específicamente con el DB (0,00001). La hipoxia se asoció (50%) con HV (0,0048), ROP (50%, 0,0341) e infecciones (54,5% 0,00001). DVC fue en 16 casos (14%). La epilepsia estuvo presente en el 47% de los casos con DVC, más del doble de la tasa global (0,0022). La HV se asoció con infecciones (<0,00001). La PCI se relacionó con apneas (0,0154) y HV (0,0112). Se demostró una relación entre ROP estadísticamente positiva con DB (<0,0002). Los trastornos oculomotores, estrabismo y nistagmo, mostraron una mayor frecuencia con defectos respiratorios, sepsis, HV y atrofia óptica. Tanto HV como DVC registraron una relación estadística directa con el estrabismo en prematuros (<0,00001). El nistagmo se relacionó con insuficiencia respiratoria, DB, apneas (0,0231) y atrofia del nervio óptico (0,0286).
Conclusiones: Las alteraciones oculomotoras en niños prematuros son las manifestaciones más relacionadas con el daño cerebral, especialmente fenómenos hipóxicos y hemorragia ventricular. La detección específica de estrabismo y nistagmo debe considerarse en la integración del diagnóstico de deterioro del neurodesarrollo. Todo esto puede representar un gran riesgo para el desarrollo neurológico en niños prematuros, conociendo esto el seguimiento debe ir dirigido a aplicar un tratamiento eficaz y oportuno para una mejor rehabilitación.
Palabras clave: ambliopía, daño cerebral, discapacidad, nistagmo, retinopatía, estrabismo.
Introducción
La Organización Mundial de la Salud ha considerado que hay 15 millones de nacimientos prematuros cada año (menor de la semana 37 de gestación) con base en 184 países. La proporción es muy diversa y va del 5% al 18% de los recién nacidos vivos, esto podría representar una proporción superior a 1 de cada 10 nacimientos, y afecta más a África y Asia meridional; también está relacionada con una baja tasa de pobreza, menor acceso a los servicios de salud y una mayor tasa de discapacidad. La discapacidad a nivel mundial cubre a más de mil millones de personas, con una calidad de vida afectada que requerirá servicios de rehabilitación y salud, con menos acceso a alternativas laborales. En México, se ha calculado un gasto de más del 85.6% para las familias con un miembro discapacitado, especialmente por los pagos de atención médica y medicamentos.
Más del 70% de los problemas de discapacidad están relacionados con el nacimiento, afectando a la persona, desde la escolaridad en la niñez hasta el empleo en la edad adulta, que por ejemplo, se ha reportado tan bajo como 30.5% para hombres y 34.7% para mujeres, de los cuales el 63,5% no recibe ayudas técnicas, el 4,6% utiliza Braille y solo el 1,6% utiliza una computadora con sistema de audio. 1,2,3
Con el aumento de la supervivencia de los bebés prematuros también hay un mayor número de personas con discapacidad. En este estudio hemos tenido como objetivo analizar las diferentes comorbilidades que pueden ocurrir en los partos prematuros, así como su efecto sobre las funciones neurovisuales, bajo la hipótesis de que conocer los riesgos que afectan el desarrollo visual del prematuro permitiría establecer una búsqueda intencional que conduzca a un diagnóstico precoz y pueda establecer un tratamiento efectivo y oportuno que permita la reducción de las cifras de discapacidad visual, incluidas las funciones perceptivas y de atención.
Material y método
Se realizó un estudio retrospectivo, transversal y descriptivo en niños prematuros que se atendieron en los departamentos de retina y estrabismo en una clínica de atención privada, desde el 1 de enero de 2015 al 1 de enero de 2019. Los criterios de inclusión se basaron en los expedientes que completaran tanto los controles como la vigilancia y el seguimiento debía cumplir un mínimo de 12 meses.
Las variables a analizar fueron seleccionadas entre los factores de riesgo y las condiciones relacionadas con el parto prematuro. La información se obtuvo a través de los padres y la derivación del pediatra y neuropediatra, incluyendo los datos generales y eventos de complicaciones: semanas de embarazo (sdg), peso al nacer, días en la Unidad de Cuidados Intensivos Neonatales (UCIN), hemorragia ventricular (HV), hidrocefalia, leucomalacia, displasia broncopulmonar (DB), parálisis cerebral infantil (PCI), epilepsia, infección neonatal, apnea. A través de los exámenes indicados para el estudio se agregaron otras variables: retinopatía del prematuro (ROP), estrabismo, nistagmo, discapacidad visual cerebral (DVC), atrofia del nervio óptico. Todos los pacientes fueron estudiados con resonancia magnética cerebral.
Para el examen de retina se aplicaron gotas de tropicamida-fenilefrina, y fue realizada por el mismo médico retinólogo. El examen estrabismológico se realizó incluyendo refracción ciclopléjica con una gota de ciclopentolato al 1% y revisión a los 45 minutos, y fue realizado por el mismo estrabólogo. Para el informe de alteraciones de refracción, clasificamos el astigmatismo como “bajo” cuando era igual o menor a 3 dioptrías y “alto” a más de 3 dioptrías.
Todos los datos fueron registrados en el expediente clínico, incluyendo el formulario de autorización de datos personales firmado por el familiar responsable y que es independiente de los informes médicos. Los informes médicos del departamento de Retina y Estrabismo fueron independientes para evitar cualquier fuente potencial de error. El tamaño total de esta investigación se completó con estos dos informes para el archivo único. Las variables cuantitativas se registraron a partir de los informes de la UCIN, peso, días de la UCIN. Los datos de las variables se registraron en el programa Excel Windows y se procesaron con estadística descriptiva. Se aplicó la prueba exacta de Fisher para tablas de contingencia 2×2 entre diferentes variables, con un nivel de significancia de 0.05.
Resultados
Fueron estudiados 113 archivos. Se incluyeron 53 hombres, 60 mujeres. Fue obtenida la información general del nacimiento, los resultados de la exploración de retina y de estrabismo, para un análisis transversal a los 12 meses de seguimiento. Edad gestacional global promedio: 30,8 +/- 3 sdg, rangos 23-38 y mediana 31. Peso 1586 +/- 660 g, rangos 510-3500, mediana 1500 g. Se notificaron embarazos múltiples en 20 casos (17,6%), 18 embarazos gemelares y 2 embarazos trillizos. Promedio en cuidados intensivos: 44 días. La edad promedio en la revisión: 3,5 +/- 2 años, rangos de 6 meses a 18 años, mediana 2 años.
Se diagnosticó como secuela: parálisis cerebral infantil en 22 casos (19,4%), siendo 90% espástica, 2 casos variedad flácida. Hemiplejía en 8 casos (7%), hidrocefalia en 6 (5,3%) de los cuales requirió válvula de derivación en 3 casos. Las complicaciones cercanas al nacimiento se registraron dentro de los primeros 3 meses: procesos infecciosos 25 (22%) con sepsis en 18 casos (15,9%) y neumonía en 6 (5,3%), hemorragia ventricular en 20 casos (17,6%), epilepsia en 20 casos, (17,6%), displasia broncopulmonar 12 (10,6%), apneas 11 (9,7%), conducto arterioso persistente 6 (5,3%), leucomalacia 5 casos (4,4%). (Ver tabla No. 1).
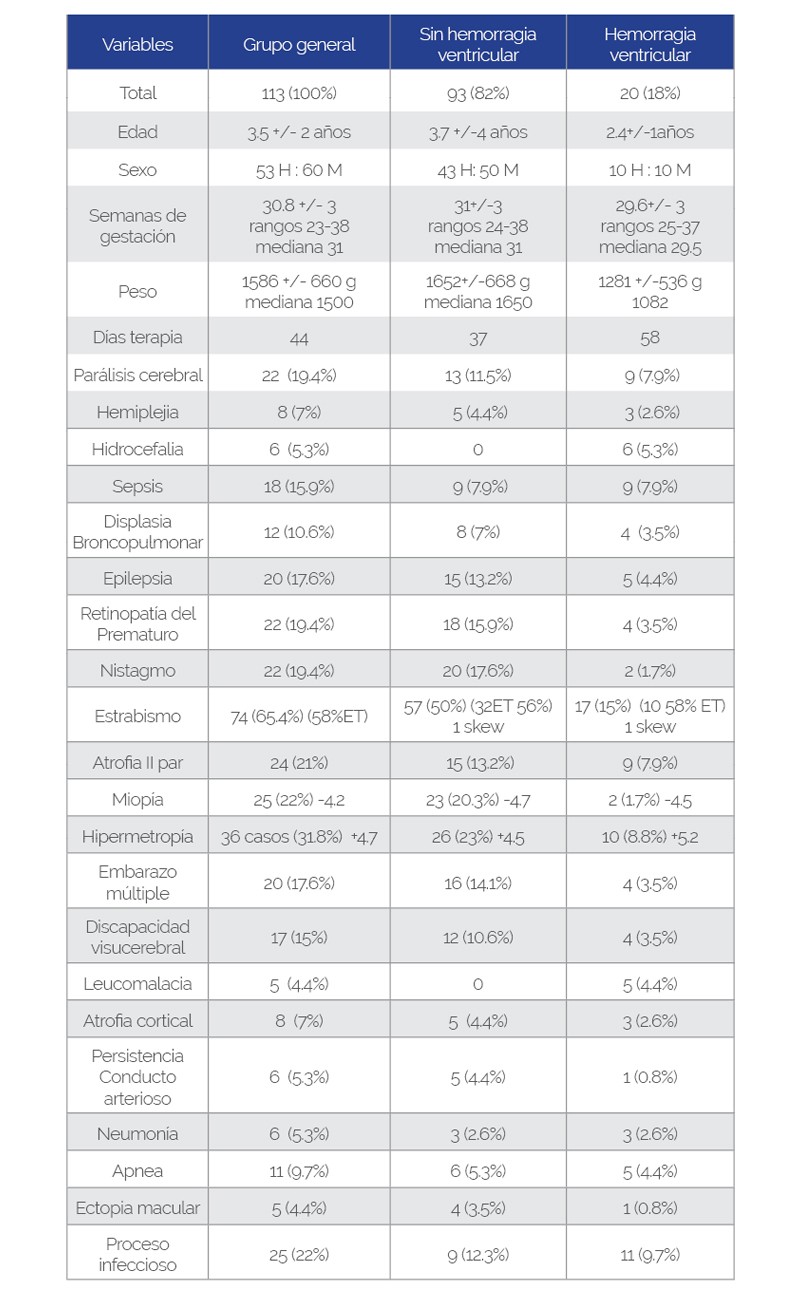
Discapacidad visual cortical
Se diagnosticó DVC en 16 casos (14%), ni el peso ni la edad gestacional fueron relevantes (30,8 g, 1642,9 dg), pero sí estuvieron más días (59,5) en cuidados intensivos. La epilepsia estuvo presente en el 47% de los casos con DVC, siendo más del doble de la tasa global, demostrando una relación estadística positiva (0,0022). No se encontró relación con ROP, infecciones o estrabismo comparado con el grupo general; pero el porcentaje (23,5%) fue mayor en nistagmo (sin significación estadística 0,3063), HV (sin significación estadística 0,4818) y PCI (sin significación estadística 0,7399).
Hemorragia ventricular
HV se presentó en el 18% de los bebés prematuros. Como complicación asociada a factores de riesgo, encontramos que la edad gestacional y el peso en el grupo de prematuros con hemorragia fueron menores (29,6 semanas, 1281 g), con relación estadística directa (0,0012), y los días de terapia intensiva fueron más (58 días), en comparación con la media. HV se asoció directamente a procesos infecciosos (sepsis, enterocolitis, neumonía) en un 60%, prácticamente 3 veces más que el global (con una significación estadística <0,00001). Se produjo leucomalacia en el 25% de los niños con HV e hidrocefalia en el 30%, en comparación con los promedios globales (4,4 y 5,3% respectivamente). Los niños con HV no se asociaron con un aumento en el número de casos de estrabismo, nistagmo, ROP, epilepsia, PCI, DB o DVC.
Displasia broncopulmonar
Los niños con dificultades respiratorias, DB y neumonía, presentaron bajo peso (1248,9 g), 28,9 sdg y más días de terapia intensiva que la media (66 días). Tanto el bajo peso (0,004) como la edad gestacional (0,0001) se relacionaron estadísticamente con el aumento del estrés respiratorio, y específicamente con la DB (0,00001). Los problemas de ventilación y oxigenación se asociaron con mayor frecuencia (50%) con HV (estadísticamente positivo 0,0048), con ROP (50% y estadísticamente positivo 0,0341), con procesos infecciosos (54,5% y estadísticamente positivo (0,00001) con sepsis (33,3%), seguido de neumonía (15,1%), enterocolitis (6%) y hepatitis (3%). Asimismo, los defectos de oxigenación y los problemas respiratorios se asociaron estadísticamente con la DVC (50%, valor de Fisher positivo 0,0125). A pesar del incremento en el porcentaje de presentación en los siguientes daños, no se demostró una relación estadística: epilepsia (27%, 0,1063), PCI (30%, 0,072), leucomalacia (10%, 0,1693), nistagmo (27,2%, 0,1063), estrabismo (69,6%, 0,2964) y atrofia del nervio óptico (27,2%, 0,3223).
Parálisis cerebral infantil
Los niños con PCI pesaron 1497 g, que resulta menor que el promedio global (no significativo 0.239), 30.4 sdg y 58.6 días en cuidados intensivos. No se relacionó con mayor DVC o ROP. Al analizar la PCI con otros factores de riesgo, se encontró una mayor frecuencia de apneas, que fue tres veces mayor que la apnea global (36%), estadísticamente significativa (0,0154), con 4 casos con paro cardiorrespiratoria y 1 caso con dextrocardia. Así como el aumento de la frecuencia de HV que fue estadísticamente significativo (36%, 0,0112). Por otro lado, los siguientes, a pesar de su mayor porcentaje de presentación, no fueron estadísticamente significativos: hidrocefalia 13,6% (0,0869), sepsis 31% (0,133), nistagmo 27% (0,3682) y atrofia óptica 36% (0,0787). Los resultados de epilepsia (18%) y estrabismo (63%) fueron similares a los globales.
Retinopatía del prematuro
Estos niños con ROP tenían un promedio de 26 +/- 1 sdg, con rangos de 23 a 30 sdg, moda de 25; peso al nacer 900 +/- 170 g, rangos de 510 a 1230 g, y estuvieron en la unidad de cuidados intensivos un promedio de 68 días. Los niños que desarrollaron ROP tenían una edad de gestación y un peso mucho más bajos en comparación con el promedio global (26 frente a 30,8 sdg y peso: 900 frente a 1586 g); y requirieron más días de hospitalización (68 vs 44 días). ROP fue más frecuente en mujeres (63,6%).
A pesar de este bajo peso y prematuridad, ROP no se asoció con mayor frecuencia de HV, ni se demostró que existiera una mayor presencia de ROP por procesos infecciosos incluyendo sepsis (valor de Fisher: 1.0), o una relación con una mayor frecuencia de PCI. (0,5585).
En general, se demostró daño retiniano en 36 casos (31,8%) de los cuales se observó tortuosidad vascular en 3 casos, ectopia macular en 5 casos. Hubo ROP en 22 niños (19,4%), siendo: ROP grado II: 3 casos, ROP III: 16 casos, ROP con enfermedad plus: 2, ROP IV: 1, ROP V: 3 casos, ninguno de estos fue bilateral, siendo el mejor ojo en ROP II, II y III. Se trataron 12 casos: 5 con aplicación de antiangiogénico intravítreo (Ranibizumab) más láser y 7 con aplicación de láser, todos ellos bajo anestesia inhalatoria.
En cuanto a los errores refractivos en niños con ROP, predominó la miopía con 54,5% (promedio -4.2) y la hipermetropía fue 18% (promedio +6,00), cifra mayor que la media global. La retina albinótica se observó en 2 casos; degeneración retiniana periférica blanca sin presión en 1 caso, degeneración en encaje en un niño de 5 años que había recibido previamente láser para ROP.
Hubo atrofia del nervio óptico en 24 casos (21%), coloboma del nervio óptico en 2 casos; bilateral (1 fue síndrome de Morning Glory), pliegues retinianos congénitos en 1 caso. Se demostró una relación entre los niños con ROP que fue estadísticamente positiva con DB (<0,0002). No fue significativo con estrabismo (0,6268) o nistagmo (1,0) en comparación con los niños sin ROP.
Estrabismo y nistagmo
Los defectos refractivos fueron: astigmatismo miópico bajo en 9 casos, astigmatismo miópico alto en 3. Astigmatismo hipermetrópico bajo en 20 casos, astigmatismo hipermetrópico alto en 1; miopía en 25 (22%) con promedio -4.2, el más alto -14.00 dioptrías, hipermetropía en 36 casos (31.8%) con promedio +4.7, el más alto +8.00 dioptrías.
Al analizar globalmente las alteraciones oculomotoras incluyendo nistagmo, estrabismo y apraxias, hubo un total de 85 casos con predominio en el sexo femenino (47 vs 38), se observó más hipermetropía (35%) con una media de +4,7 dioptrías, en comparación con el 20% de miopías con un promedio de -5,3%; teniendo en cuenta que en los niños sin estrabismo, la miopía apareció en el 35,7% con una media de -2,1 y con hipermetropía en el 7% con una media de +5,5. El porcentaje de hipermetropía en el grupo de niños sin estrabismo es significativamente menor que en el grupo global, y la relación como factor de riesgo entre hipermetropía en prematuros y estrabismo fue estadísticamente significativa (0,0051). Los niños de bajo peso presentaron más estrabismo (1574g en niños con estrabismo vs 1623g en niños sin estrabismo), pero ni bajo peso ni las semanas de gestación como variables registraron relación estadística con el estrabismo (0,6638, 0,8276), ni el mayor tiempo en la UCIN (46 días vs 31,5 en niños sin estrabismo) (0,5526).
El estudio entre el grupo de prematuros con trastornos oculomotores, estrabismo y nistagmo, en comparación con el grupo sin ellos, mostró una mayor frecuencia de defectos respiratorios (40 vs 25%), mayor frecuencia de sepsis (23,7 vs 10,5%), más niños con hemorragia ventricular (21% vs. 10,7%) y atrofia óptica (21 vs. 14%), aunque esta última no era un marcador de riesgo de estrabismo a menos que hubiera generado pérdida visual (0,5868).
En ambos grupos, con y sin estrabismo, se identificó daño de ROP (20 vs 17,8%) cuya relación con el número global no fue estadísticamente significativa. Tanto la HV como la DVC registraron una relación estadística directa con la presencia de estrabismo en prematuros (prueba exacta de Fisher <0,00001), y no así con leucomalacia, epilepsia o PCI, que en niños con estrabismo se encontró en 22,3%, porcentaje superior al global, y en comparación con niños sin estrabismo 17,8% (0,7914); y aunque la sepsis fue un porcentaje mayor, no encontramos significación estadística en comparación con los niños sin estrabismo (0,1184).
Para identificar mejor si el nistagmo contribuía al mayor riesgo, se expusieron al grupo de niños sin nistagmo, encontrando una mayor correlación estadística entre insuficiencia respiratoria, especialmente DB y apneas (0,0231), y presencia de atrofia del nervio óptico (0,0286), no así con PCI, HV, hidrocefalia, ROP o DVC. Al estudiar solo a los niños con nistagmo, estos tenían más días en cuidados intensivos (57), menor edad gestacional (31,1 dg), pero no en peso (1648,9 g); en comparación con niños con estrabismo sin nistagmo (peso: 1550,4 g, 41,8 dg, 41,8 días en UCIN).
Sobre el tipo de estrabismo, que se diagnosticó en 74 casos (65,4%) fueron: endotropia en 42 casos (56,7%), exotropia en 28 (37,8%), espasmo de convergencia 2, desviación oblicua o skew deviation en 2; todos los casos de endotropia fueron: endotropia congénita, de los cuales presentaron patrón de fijación cruzada y gran ángulo en 4 casos, microestrabismo en 5, asociado a Desviación Vertical Disociada en 5. Exotropia: exotropia constante en 15 casos, exotropia intermitente en 11, y exoforia en 2. Requirieron tratamiento por ambliopía en 20 casos de estrabismo, se indicó quimiodenervación con toxina botulínica en 5 casos y se requirió cirugía de estrabismo en 7 casos. Se diagnosticó nistagmo en 22 casos (19,4%) y 3 casos requirieron cirugía de nistagmo.
Discusión
Lograr una buena maduración visual, transmisión de imágenes adecuada, percepción de la imagen y luego comprensión y respuesta consistente, depende de la eficiencia de las estructuras cerebrales en diferentes niveles. La captura de imagen en ambas retinas se transformará de estímulos lumínicos a códigos neuronales que por diversas vías cerebrales estimularán la percepción, comprensión y respuesta de forma compleja e individualizada, para luego ser almacenada en las funciones de memoria que favorecerán la posterior estrategia de aprendizaje e inteligencia de la persona.
DVC
Cuando hay una interrupción en cualquiera de estos niveles, estos procesos neurosensoriales visuales pueden dañarse y las manifestaciones suelen ser múltiples, de gran variabilidad. Se pueden caracterizar, por ejemplo, desde patrones comunes y fácilmente identificables, hasta otros patrones con signos tan leves que pueden pasar desapercibidos, y esto no quiere decir que sean menos dañinos. Las diversas alteraciones en la integración de las imágenes están contenidas en el concepto de DVC, y generalmente no corresponden necesariamente a una lesión ocular.
Esta DVC con deficiencias en el procesamiento y el aprendizaje visuoespaciales puede afectar el desarrollo del niño tanto en las habilidades motoras como mentales y puede ser limitante para la independencia y calidad de vida. La dificultad para identificar todas las manifestaciones que pueden sumarse a la DVC puede retrasar la posibilidad de una rehabilitación temprana. La frecuencia con la que puede aparecer en el niño prematuro es una de las razones para anticipar la búsqueda dirigida de estas alteraciones.
Una de las causas más importantes de DVC es la encefalopatía hipóxico-isquémica perinatal, que afecta especialmente a la sustancia gris, hipocampo, tálamo y tronco encefálico; así como las lesiones de leucomalacia periventricular que se presentan en el prematuro asociadas a hemorragia ventricular. En ambas situaciones, habrá daño asociado con áreas sensoriales y motoras, daño cognitivo con PCI. Otras causas de DVC son lesiones cerebrales traumáticas, procesos infecciosos y episodios convulsivos. 4
En el presente trabajo, hemos evaluado los diferentes riesgos asociados con la prematuridad. Algunas son muy evidentes y ya conocidas, pero la relación estadística permitió identificar mejor estas correspondencias.
La DVC en los bebés prematuros guardan una relación directa específicamente con la presencia de epilepsia, que tiene un significado desestabilizador significativo, por lo que es necesario mantener el cuadro convulsivo lo más estable posible. Existe la posibilidad de convulsiones en los niños que han sufrido una hemorragia ventricular, por lo que analizamos este riesgo, que ya se ha asociado con bajo peso y pocas semanas de embarazo, y sepsis; y luego, aunado a la leucomalacia, que a su vez puede afectar la comunicación axonal adecuada y ser un factor en el desarrollo de PCI. Asimismo, se debe tener en cuenta la mayor frecuencia de nistagmo y su relación con el estrabismo ya que la DVC puede empeorar con los fenómenos de ambliopía, y los mecanismos de atención en el niño.
HV, DB, leucomalacia, sepsis y PCI.
Los niños menores de 28 sdg tienen aproximadamente tres veces más probabilidades de sufrir una hemorragia ventricular grave que los del grupo de 28-31 sdg. Parece que la vasodilatación resultante de la hipoxia o la hipercapnia inicia el evento y la presión intravascular puede exceder la presión intersticial, con la posterior ruptura de los capilares de la matriz germinal, estasis, trombosis y hemorragia ventricular.
La matriz germinal subependimaria contiene las células madre neuronales y la glía, que migran a partir de la semana 26 de gestación. Se trata de una capa gelatinosa ubicada entre el núcleo caudado y el tálamo. Es notorio entre las semanas 26 a 34 y desaparece hacia la semana 40 de gestación. La matriz germinal está muy vascularizada y recibe irrigación de ramas de la arteria cerebral media, la arteria cerebral anterior y la arteria carótida, y el drenaje venoso va a la vena de Galeno. De la semana 26 a la 34 los vasos están formados por una fina capa de endotelio sin capa muscular, elastina ni colágeno. Las células endoteliales contienen una gran cantidad de mitocondrias y tienen un alto requerimiento de metabolismo oxidativo.
Cuando ocurre una hemorragia en la matriz germinal subependimaria, el sangrado puede originarse en la zona vascular de la capa de la matriz germinal, que en los recién nacidos a término y el 10% de los prematuros ocurre en el plexo coroideo o en el techo del cuarto ventrículo; y en niños menores de 28 semanas de embarazo, puede ocurrir sangrado en la matriz germinal del cuerpo o la cabeza del núcleo caudado. Los cambios neuropatológicos crónicos observados después del sangrado de la matriz germinal pueden dejar una lesión quística subependimaria.
El HV puede diseminarse y la sangre extravasada puede causar aracnoiditis y dilatación aguda del sistema ventricular, que ocurre en el 50% de los casos, provocando daño por compresión e hidrocefalia, que puede ser comunicante o no comunicante. En el comunicante, hay obstrucción a nivel del Agujero de Monro, el acueducto cerebral de Silvio o el foramen de Luschka o Magendie. La dilatación ventricular suele ser rápida y la hidrocefalia clínica es evidente dentro de las dos semanas posteriores a la hemorragia.
Algunos factores que pueden causar HV son: fluctuaciones en el flujo sanguíneo cerebral debido a dificultad respiratoria, aumento de la presión arterial, vasodilatación máxima asociada con hipercapnia o hipoxemia, o ambas, aumento de la presión venosa central, mayor uso de ventilador mecánico, neumotórax, aspiración traqueal, trastornos de la coagulación, expansión rápida del volumen sanguíneo, convulsiones, conducto arterioso persistente, procedimientos dolorosos, uso de dexametasona, vasopresores, cafeína, entre otros. Puede ocurrir con más frecuencia entre las 24-48 horas después del nacimiento y es más común en madres muy jóvenes con un peso bajo del niño <1500 g, o una edad gestacional más baja, ocurriendo hasta en un 90% en niños menores de 32 semanas.
La leucomalacia periventricular es una complicación que se produce por necrosis de la sustancia blanca periventricular, dorsal y lateral a los ángulos externos de los ventrículos laterales. Generalmente, existe la participación de la región adyacente a los trígonos y cuerpo occipital, asta frontal y cuerpo ventricular (centrum semiovale). Se asocia a infección materna, corioamnionitis, hipocapnia (<CO2), entre otras. Dependiendo del grado de lesión, se puede asociar a diplejía espástica y PCI, lesiones sensoriales y neurales, tanto visuales como auditivas, somestésicas y cognitivas. En una revisión de 2.113 bebés prematuros, fue posible analizar el impacto en el neurodesarrollo asociado a diferentes factores de riesgo. 5,6
La sepsis aumenta significativamente la morbilidad de los prematuros y es inversamente proporcional a la edad gestacional, relacionada con el bajo peso y asociada a los efectos de la hipotensión y disminución del flujo cerebral, que pueden tener efectos importantes sobre la sustancia blanca y por tanto con daño cognitivo y motor, memoria, funciones, mecanismos de atención y PCI; por lo tanto, debe considerarse como un posible factor de riesgo de trastornos del neurodesarrollo a largo plazo en bebés prematuros. 7
Podemos observar que el factor más importante para la presencia de HV y DVC fue la DB, francamente asociados a fenómenos hipóxicos, por lo que también estará relacionado con una mayor frecuencia de ROP, y se encuentra especialmente en niños de bajo peso y muy prematuros.
Aunque los efectos sobre los niveles de saturación entre 85-89% frente a 91-95% mostraron menor posibilidad de retinopatía del prematuro, hay que considerar que también se han asociado a un aumento de la mortalidad en niños extremadamente prematuros. Ante la DB, la oxigenoterapia requiere en ocasiones una mayor agresividad y, en consecuencia, se observará mayor ROP, que, si bien puede considerarse multifactorial, la presencia de ROP puede resultar en un marcado de daño neurológico y sensorial.8
ROP, estrabismo y nistagmo
Varias publicaciones han mencionado como factores de riesgo en el desarrollo de ROP: hiperoxia, oxigenación de larga duración, ventilación artificial especialmente mayor de 7 días, episodios de hipoxemia, DB, apneas, transfusiones de sangre, anemia, sepsis, enterocolitis, acidosis metabólica, apgar bajo, asfixia, HV, cardiopatía, alteraciones de la glucosa, hipotensión, neumotórax, uso de esteroides pre y posnatales, uso de antibióticos y xantinas como aminofilina y teofilina, tratamientos con indometacina, fototerapia y requerimientos de nutrición parenteral.
Acerca del estrabismo, aunque la anomalía asociada con la ectopia macular, la atrofia óptica o el desprendimiento de retina por sí sola puede ser una causa de estrabismo, no hubo una relación estadísticamente significativa entre los niños que tenían ROP, por lo que no se mostró una tendencia global al estrabismo y al nistagmo, comparado con el universo de niños prematuros o niños sin ROP (niños con ROP: 54,5% de estrabismo y 18% de nistagmo, vs estrabismo global 65,4% y 19,4% de nistagmo). Pero se observó un cambio ya que, si bien el estrabismo más frecuente en este trabajo fue la endotropia, en los niños con ROP hubo un mayor porcentaje de exotropía (66%). El estrabismo se relacionó con pérdida visual por atrofia del nervio óptico o desprendimiento de retina en el 50%, siendo solo por ectopia en el 16,6%, esto podría explicar la mayor frecuencia de exotropías.
Podemos identificar el estrabismo como un factor de riesgo asociado a HV y para DVC; y nistagmo a DB, hipoxia, apneas y atrofia del nervio óptico. Esta diferencia podría estar causada, la primera por cambios neuronales debidos a los fenómenos de ambliopía; y probablemente nistagmo por una lesión hipóxica y metabólica más difusa.
La ambliopía es una de las causas más importantes de daño visual en todo el mundo. Las alteraciones neurológicas en la ambliopía comienzan antes del establecimiento de la integración binocular de los impulsos talamocorticales, con cambios de “Depresión sináptica a largo plazo” (DLP) en las sinapsis de la corteza visual con activación aguda de los receptores NMDA mediada por los receptores AMPA. Estos cambios que ocurren en varias áreas del cerebro, por ejemplo en la región CA1 del hipocampo, y son similares a lo que ocurre en las capas 2-4 de la corteza visual (a diferencia de la capa 6 que requiere la activación del receptor de glutamato 5, mGluR5); y que finalmente comparte dos características: el impacto sobre el daño visual debido al fallo de un estímulo visual adecuado, se produce muy temprano; y segundo: que las alteraciones estructurales de las conexiones sinápticas son secundarias a la DLP. Ambos cambios pueden estar estrechamente correlacionados con una disfunción cerebral observada en la DVC, y la ambliopía puede impedir el estímulo binocular adecuado y afectar los mecanismos de atención, aprendizaje y desarrollo de los diferentes tipos de inteligencia en el niño.9,10
La ambliopía es uno de los factores más urgentes en la rehabilitación del prematuro. La posibilidad de que las lesiones binoculares por daño en la recepción retinotópica en la corteza visual primaria puedan lograr una reorganización a través de la recuperación axonal con una remodelación en la interconectividad e incluso la recuperación de la conectividad originalmente dañada, sugiere que la plasticidad depende de la experiencia, atención y actividad que pueden ser estimuladas para favorecer y consolidar los cambios dinámicos necesarios para las funciones perceptivas visuales.11
El concepto de “Aprendizaje perceptual” (AP) se ha basado en ejercicios visumotores repetitivos que mejoran las habilidades visuales y que logran un cambio estructural y bioquímico transfiriéndolo a potenciación sináptica de largo plazo, a través de mecanismos de plasticidad. Estos procesos ocurren de manera más importante durante la infancia y requieren la participación de múltiples circuitos, cambios tempranos en ellos y una adecuada interconectividad. Múltiples estudios han demostrado la participación y trabajo integral para funciones perceptuales entre la corteza visual primaria, corteza medial y área intraparietal lateral, áreas frontoparietal, temporomedial, entre otras; cuyas variadas respuestas pueden estar sujetas al tipo de estimulación, orientación, velocidad, la dirección del movimiento, contraste, etc., y que podrían estimular los circuitos cerebrales por diferentes mecanismos neuronales, tanto para la discriminación como para la detección y comprensión de los estímulos visuales.
Los mecanismos de atención permitirán al niño, desde los primeros meses de vida, categorizar la información más relevante sobre lo no importante de todas las señales transmitidas, por lo que las funciones de atención resultan fundamentales para poder implementar el manejo a través de aprendizaje perceptual. Estos mecanismos de atención logran su maduración mediante una conectividad más efectiva entre grupos neuronales que transportan información relevante con patrones de sincronización selectiva, que a su vez son capaces de modular patrones de interacción hacia otros grupos neuronales para mejorar respuestas visomotoras más complejas. 12
Las funciones de los mecanismos de atención selectiva no solo mejoran la sincronización de las zonas neuronales correspondientes al estímulo sino también son esenciales para suprimir el grupo neuronal correspondiente al estímulo no relevante que no requiere de atención en ese momento, por ejemplo, cuando estamos ante una lectura y atendemos únicamente el párrafo contínuo. Esta atención selectiva se activa incluso fracciones de segundos previos a la llegada del estímulo, y continúa con una adecuada sincronización para procesar la infromación al tiempo y en la mejor calidad.13
Las estructuras cerebrales activadas durante los mecanismos de atención operan en varios niveles de procesamiento y son necesarias tanto para la percepción espacial, la preparación, la respuesta, las funciones sensoriomotoras, como para los conceptos de identidad y sociales; por ejemplo, la unión temporoparietal que incluye la referencia y cognición social en la que la persona puede discernir el estado mental de los demás o sentir empatía.14
Hemos tenido en cuenta para el reporte del presente estudio las limitaciones ante defectos de información o falla en los métodos de diagnóstico por imagen, especialmente cuando los prematuros no recibieron una atención hospitalaria más integral. En el presente estudio no se incluyeron archivos que no contaban con estudios completos, por lo que este mismo factor puede modificar los resultados estadísticos. Por ello, dejamos abierta la posibilidad de que, aunque algunas variables resultaron en un menor valor de riesgo significativo, continúen considerándose como un probable factor de daño cerebral.
Conclusiones
Los efectos neurovisuales que ocurren en el bebé prematuro pueden ser múltiples, diversos y peligrosos. Los conceptos actuales de DVC incluyen diversas alteraciones en la percepción, comprensión y capacidad de respuesta del niño. Riesgos como HV, DB, hidrocefalia, epilepsia, leucomalacia, estrabismo, nistagmo, ROP, pueden ser factores que pueden incrementar los índices de PCI, dificultades de aprendizaje, en los mecanismos de atención y en los diferentes tipos de inteligencia, incluida la emocional.
La detección temprana de los factores de riesgo y de tipo de discapacidad visual pueden ayudar a establecer un tratamiento de manera más eficaz al instalarlo oportunamente. Un manejo adecuado de los fenómenos de estrabismo, nistagmo y ambliopía, considerando los efectos sobre la interconectividad cerebral múltiple, mejoraría las condiciones de las funciones de atención, memoria, habilidades psicosociales y visuomotoras, impactando globalmente en una mejor calidad de vida.
Referencias
WHO: PRETERM BIRTH. https://www.who.int/es/news-room/fact-sheets/detail/preterm-birth (19 Jun 2020)
WHO. WORLD DISABILITIES. https://www.who.int/disabilities/world_report/2011/es/ (19 Jun 2020)
SEDESOL. Diagnóstico sobre la situación de las personas con discapacidad en México. 2016. Secretaría de Desarrollo Social. (Accesed 19 jun 2020)https://www.gob.mx/publicaciones/articulos/diagnostico-sobre-la-situacion-de-las-personas-con-discapacidad-en-mexico?idiom=es
Martín MB, Santos-Lozano A, Martín-Hernández J, López-Miguel A. Cerebral versus Ocular Visual Impairment: The Impact on Developmental Neuroplasticity. Frontiers Psychol. 2016. 1-9://doi.org/10.3389/fpsyg.2016.01958
Adams-Chapman I, Heyne RJ, DeMauro SB, Duncan AF, Hintz SR, Pappas A, Vohr BR, et al. Neurodevelopmental Impairment Among Extremely Preterm Infants in the Neonatal Research Network. Pediatrics. 2018 May; 141(5): e20173091. DOI: 10.1542/peds.2017-3091 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5914487/#__ffn_sectitle
Roman-Lantzy Ch. Cortical Visual Impairment. Provincial Resource Centre for Visually Impaired. 2010. March 4- 5; 6-19.
Cai S, Thompson DK, Anderson PJ, Yang JY. Short- and Long-Term Neurodevelopmental Outcomes of Very Preterm Infants with Neonatal Sepsis: A Systematic Review and Meta-Analysis. Children (Basel). 2019 Dec; 6(12): 131. DOI: 10.3390/children6120131
8) Podraza W, Michalczuk B, Jezierska K, Domek H, Kordek A, Łoniewska B, Modrzejewska M, Kot J. Correlation of Retinopathy of Prematurity with Bronchopulmonary Dysplasia. Open Med (Wars). 2018; 13: 67–73 https://dx.doi.org/10.1515%2Fmed-2018-0012
Sidorov MS, Kaplan ES, Osterweil EK, Lindemann L, Bear MF. Metabotropic glutamate receptor signaling is required for NMDA receptor-dependent ocular dominance plasticity and LTD in the visual cortex. Proc Natl Acad Sci U S A. 2015 Oct 13; 112(41): 12852–12857. DOI: 10.1073/pnas.1512878112
Coleman JE, Heynen AJ, Bear MF. The molecular and structural basis of amblyopia. In: Werner J, Chalupa L. The New Visual Neurosciences. Massachusetts 2014, MIT Press. 100: 1433-1444.
Li W, Gilbert CH. Perceptual learning and plasticity in Primary Visual Cortex. En Werner J, Chalupa L. The New Visual Neurosciences. Massachusetts 2014, MIT Press. 70: 1001-1011.
Sasaki Y, Watanabe T. Perceptual learning. In: Werner J, Chalupa L. The New Visual Neurosciences. Massachusetts 2014, MIT Press. 69: 991-999.
Womelsdorf T, Bosman C, Fries P. Selective neuronal synchronization and Attentional stimulus selection in Visual Cortex. In: Werner J, Chalupa L. The New Visual Neurosciences. Massachusetts 2014, MIT Press. 71:1013-1030.
Boynton G, Kastner S. Neuroimaging Studies on Human Attention Networks in Visual and Frontoparietal Cortex. En Werner J, Chalupa L. The New Visual Neurosciences. Massachusetts 2014, MIT Press. 75:1092-1093.

Autor Dra. Silvia Moguel Ancheita
Oftalmólogo, Estrabólogo, Máster en Neurociencias.
Jefe del Departamento de Estrabismo, “Mira” Centro Oftalmológico. San Francisco 1626-605, Col Del Valle, Alcaldía Benito Juárez, Ciudad de México. MÉXICO.
[email protected]

Coautor Dr. Luis Porfirio Orozco Gómez
Oftalmólogo. Retinólogo.
Jefe del Servicio de Oftalmología. Centro Médico Nacional “20 de Noviembre”, ISSSTE.
Jefe del Departamento de Retina. “Mira” Centro Oftalmológico. San Francisco 1626-605, Col Del Valle, Alcaldía Benito Juárez, Ciudad de México. MÉXICO.

